Az élőlények komplex sejt- és élettani folyamatainak finomhangolása szükséges molekuláris szinten, hogy például egy állat vagy növény alkalmazkodhasson az élőhelyhez. E célból számos molekula beavatkozik olyan folyamatokba, mint a sejtkommunikáció, az anyagcsere vagy a sejtosztódás. Ezen molekulák egyike a fehérje Calmodulinamely a kalcium segítségével befolyásolja sok más biológiailag aktív fehérje működését.
Mi az a kalmodulin?
A kalmodulin egy intracelluláris szabályozó protein, amely köti a kalciumionokat. Szerkezete miatt az EF kézfehérjék csoportjába tartozik. A kalmodulin alakja, amely 148 aminosavból áll és 6,5 nm hosszú, súlyzóra emlékeztet. Ennek a protein molekulanak a molekulatömege körülbelül 17 kDa.
A sejten belüli jelátvitelben betöltött biológiai funkciója miatt a kalmodulin egy második hírvivő anyagként is besorolható, azaz egy másodlagos hírvivő anyagként, amely azonban önmagában nem enzimatikusan aktív. A fehérje két gömb alakú doménjében két spirál-hurok-spirál motívum található 1,1 nm távolságra, amelyekhez összesen négy kalciumion köthető. Ezt a struktúrát EF kéznek nevezzük. Az EF kezeket hidrogénkötések kötik össze a kalmodulin antiparallel béta-lemezei között.
Funkció, hatás és feladatok
A kalmodulinnak molekulánként három-négy kötött kalciumionra van szüksége ahhoz, hogy aktív legyen. Aktivált állapotban a képződött kalcium-kalmodulin komplex számos receptor, enzim és ioncsatorna szabályozásában vesz részt, sokféle funkcióval. A szabályozott enzimek tartalmazzák a foszfatáz-kalcineurint, amely fontos szerepet játszik az immunválasz szabályozásában, és az endotél nitrogén-oxid-szintázt (eNOS), amely NO-t termel, amelyet többek között a simaizmok relaxációjára és ezáltal a Véredény.
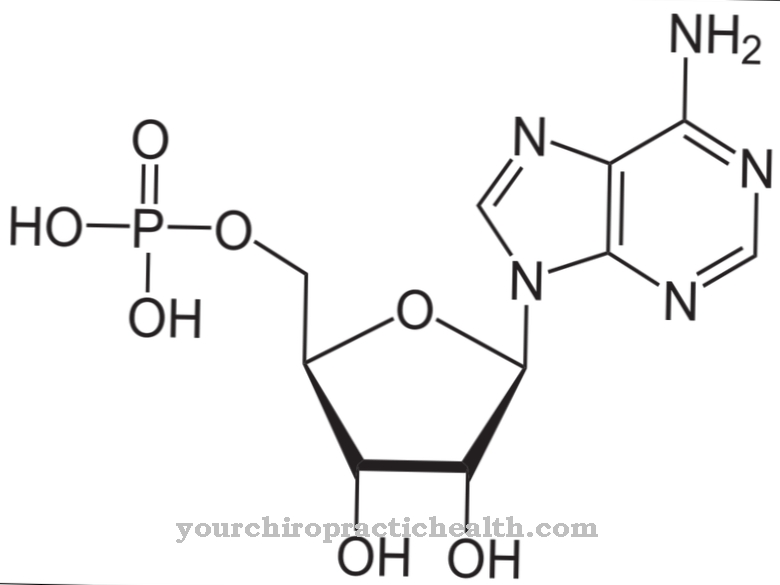
Alacsony kalcium-koncentrációknál az adenilát-cikláz (AC) is aktiválódik, magas kalcium-koncentrációknál viszont az enzimatikus ellenpár, a foszfodiészteráz (PDE) aktiválódik. Ilyen módon a szabályozó mechanizmusok kronológiai sorrendjét érjük el: kezdetben az AC egy jelútvonalat mozgásba hoz egy ciklikus AMP (cAMP) előállításával, később ezt az ellenfél PDE ismét kikapcsolja a cAMP degradációja révén. Azonban a kalmodulin szabályozó hatása a proteinkinázokra, például CaM kináz II-re vagy miozin könnyű lánc kinázra (MLCK), amelyet az alábbiakban részletesebben ismertetünk, különösen ismert.
A CAMKII kötődik egy foszfátmaradékhoz különböző fehérjékhez, ezáltal befolyásolhatja az energiacserét, az ionok permeabilitását és a neurotranszmitterek felszabadulását a sejtekből. A CAMKII különösen magas koncentrációban található az agyban, ahol fontos szerepet játszik az idegrendszer plaszticitásában, azaz minden tanulási folyamat. De a kalmodulin elengedhetetlen a mozgási folyamatokhoz is. Nyugalomban az izomsejtekben a kalciumionok koncentrációja nagyon alacsony, ezért a kalmodulin inaktív. Ha azonban az izomsejt izgatott, a kalcium beáramlik a sejtplazmába, és kofaktorként elfoglalja a kalmodulin négy kötési helyét.
Ez most aktiválhatja a miozin könnyű lánc kinázát, amely elmozdítja a zsugorodó szálakat a sejtben, és ezáltal lehetővé teszi az izmok összehúzódását. Egyéb, kevésbé ismert enzimek, amelyek a kalmodulin hatása alatt állnak, a guanilát-cikláz, a Ca-Mg-ATPáz és a foszfolipáz A2.
Oktatás, előfordulás, tulajdonságok és optimális értékek
A kalmodulin előfordul minden eukariótában, amely magában foglalja az összes növényt, állatot, gombát és az amoeboid lények csoportját. Mivel ezekben a szervezetekben a kalodulin molekula általában viszonylag hasonló módon van felépítve, feltételezhető, hogy ez egy evolúciós szempontból nagyon régi protein, amely a korai szakaszban kialakult.
Általában a kalmodulin viszonylag nagy mennyiségben van jelen a sejt plazmájában. Az idegsejtek citoszoljában például a szokásos koncentráció 30-50 µM körül van, azaz 0,03-0,05 mol / L A fehérjét a transzkripció és a transzláció során alakítják ki a CALM gén alkalmazásával, amelyből három, eddig ismert allél létezik, amelyeket CALM-1, CALM-2 és CALM-3-nak neveznek.
Betegségek és rendellenességek
Vannak olyan vegyszerek, amelyek gátló hatással lehetnek a kalodulinra, és ezért kalmodulin gátlókként ismertek. A legtöbb esetben gátló hatásuk azon a tényen alapszik, hogy kiszállítják a kalciumot a sejtből, és így eltávolítják azt a kalmodulinból, amely akkor csak inaktív állapotban van jelen.
Ezen gátló anyagok közé tartozik például a W-7. Ezen felül néhány pszichotróp fenotiazin gyógyszer gátolja a kalmodulint. Akár olyan széles, mint a kalmodulin szabályozó funkciói, annyira változatosak az elképzelhető hibák és rendellenességek, amikor a fehérjét a kofaktor kalcium már nem képes aktiválni, és a szabályozott cél enzimek maguk is kevésbé aktívak. A CAMKII nem megfelelő aktiválása például az idegi plaszticitás korlátozásához vezethet, amely a tanulási folyamatok alapját képezi.
Az MLCK aktiválásának csökkentése rontja az izmok összehúzódását, ami mozgási rendellenességekhez vezethet. A kalcineurin enzim kevesebb aktiválása a kalmodulin hiány miatt befolyásolja a test immunválaszát, és az eNO-k kevésbé történő aktiválása alacsonyabb NO koncentrációkat eredményezne. Ez utóbbi elsősorban olyan problémákat okoz, amelyekben a salétrom-oxid állítólag megakadályozza a nem kívánt véralvadást és kitágítja az ereket a jobb vérkeringés érdekében. Ugyanakkor azt is megemlíteni kell, hogy a Frequenin kalciumérzékelő bizonyos körülmények között átveheti a kalmodulin biológiai funkcióit, és így helyettesíti a molekulát.


.jpg)



.jpg)
.jpg)





.jpg)